搜索
2021-12-17 / 技术新闻
在分子检测当中,qPCR与LAMP是两个比较热门的方法。两个技术各有拥护者,大家都觉得各自的技术是更加先进的。相信很多人都接触或者听说过这两个技术,但二者之间的差别在哪里,孰优孰劣?很多人或许就没有深入了解了。今天,我们在这里就对两个技术做一个比较。
要了解这两个技术的差别,首先我们要了解这两个方法的原理。
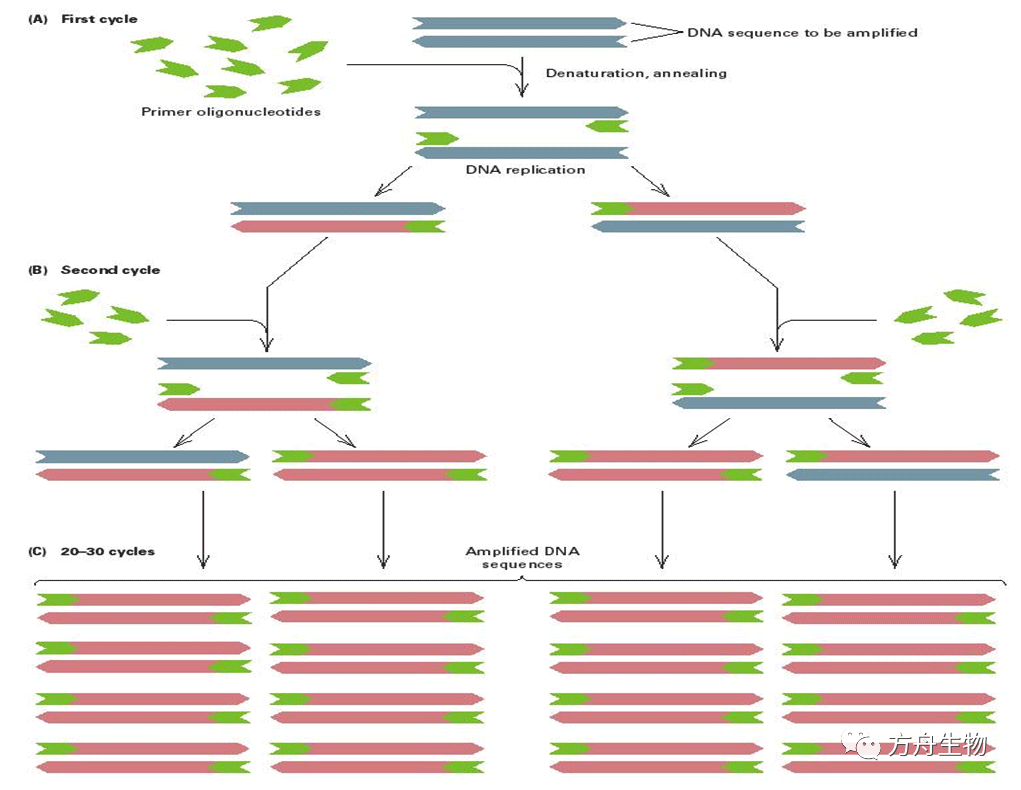
上面是PCR扩增过程的一个简图,PCR扩增分为三个过程。第一,变性,通过温度的升高,通常为94摄氏度左右,让模板DNA双链解链为单链,为接下来引物的结合提供条件;第二,退火,通过降低温度,通常为55摄氏度左右,让引物与单链DNA特异性结合,以便Taq酶进行碱基延伸;第三,延伸,再次升高温度,通常为70-75摄氏度,Taq酶以结合到单链DNA上的引物的3’端为起点,以DNA链为模板进行延伸。然后又回到第一步变性,如此循环,目标基因片段就会得到指数倍的扩增,经过40个循环,目标基因片段可以获得百万倍的扩增。
在qPCR中,会在反应体系中加入荧光探针或者荧光染料,探针或者染料结合到合成的DNA链上,引发荧光反应,DNA合成越多,荧光的强度也就越大,通过光度计探测荧光的数值,也就可以换算出合成DNA的量,接着计算出DNA模板的起始量。这就qPCR原理的简单描述。
接下来我们再看看LAMP法的原理。
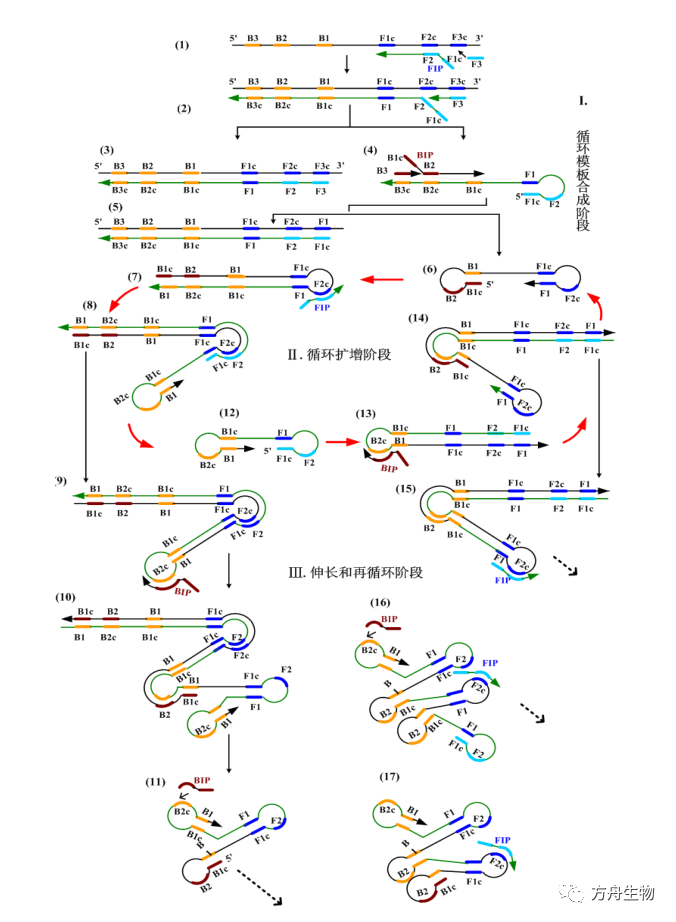
LAMP法的关键是在引物的设计上。相比较普通PCR方法,LAMP法需要设计两对引物FIP和BIP,F3和B3。这两对引物与模板DNA在具有链置换活性的BstDNA聚合酶于60-65摄氏度恒温环境下,产生带环状结构的产物,接着引物又与环状中的单链部位结合,继续产生带环状的产物,如此引发目的基因的高效扩增。
LAMP法最具特色的地方是由引物的巧妙设计,不断产生带环状结构产物,然后引物以环状中的单链位置为结合位点,在双链没有解链的情况下不断发生新链的合成。
由于二者的扩增过程的不同,导致二者表现出来的特点也不一样。
1 需要的仪器设备不同。因为LAMP法是在恒温条件下进行扩展,所以LAMP法所需要的设备只需要一个能产生恒定温度即可,对于仪器的要求比较低,而qPCR需要在变性、退火、延申三个不同温度下不断切换,所以需要一个能快速产生温度变化的设备,这对设备的要求会比较高,因为如果仪器变温速度不够快,会导致非特性扩增,影响结果的准确性。所以早期的qPCR设备都很昂贵,动辄几十万,不过现在很多设备的价格都已经降了下来,像方舟生物的qPCR仪价格就是很实惠的了。
2 操作过程不同。两个方法大同小异,基本过程都如下图所示。

DNA的提取过程都差不多,不同点主要在中间的扩增过程和后续的判读上。因为各自扩增的特点,扩增的过程、时间和产生的产物都不一样。LAMP法是在恒温条件下进行的,所以只要设定一个温度即可进行工作,qPCR则需要设定三个不同的温度进行循环。LAMP法一般在15-60分钟内完成,可产生10^9-10^10倍的产物,qPCR一般进行40个循环,所需时间在60分钟内,可产生百万倍的扩增产物。也就是说LAMP的扩增效率更高。
3 结果判读方式不同。qPCR通常是采用实时荧光检测进行结果判读,而LAMP则有多种方式,浊度法,荧光法,电泳法等。但是因为LAMP的特点,他的结果是没有特异性的,也即是说他只是判断是否发生扩增,而不能对非特异性扩增进行判断,这也导致LAMP假阳性的结果比较多,且只能进行定性而不能进行定量检测,影响LAMP大规模推广。而qPCR可通过荧光探针的方法进行结果判读,具有特异性和定量的特点。
4 结果准确性。LAMP方法有两对引物,因此其扩增的特异性比较高,但是由于其灵敏性很高(产物可达10^10倍),所以也导致LAMP的实验环境要求很高,因为少量的污染也可能导致假阳性的产生,另外LAMP的引物浓度比较高,有时会发生引物间的配对,引发扩增,导致假阳性,这些都是影响LAMP推广的因素。相对应的,qPCR的结果是比较可靠的。
5 检测通量。由于结果判读的方式不同,LAMP一个实验只能进行一个目的基因的检测,而qPCR可通过引物与探针的设计,进行多通道检测,从未实现一个实验检测多个目的基因。
6 另外,LAMP对于长链目前基因的扩增效率比较慢,所以LAMP只能进行短链扩增,这也影响了LAMP的应用场景。
综上所述,LAMP与qPCR各有优劣,但在目前对检测结果高准确型,高通量等要求下,qPCR的应用还是更加广一些。